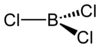
போரான் முக்குளோரைடு
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
போரான் டிரைகுளோரைடு
| |||
| வேறு பெயர்கள்
போரான்(III) குளோரைடு
முக்குளோரோபோரேன் | |||
| இனங்காட்டிகள் | |||
| 10294-34-5 | |||
| ChemSpider | 16788234 | ||
| EC number | 233-658-4 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 25135 | ||
| வே.ந.வி.ப எண் | ED1925000 | ||
| |||
| UNII | K748471RAG | ||
| பண்புகள் | |||
| BCl3 | |||
| வாய்ப்பாட்டு எடை | 117.17 கி/மோல் | ||
| தோற்றம் | நிறமற்ற வாயு, காற்றில் புகையும் | ||
| அடர்த்தி | 1.326 கி/செ.மீ3 | ||
| உருகுநிலை | −107.3 °C (−161.1 °F; 165.8 K) | ||
| கொதிநிலை | 12.6 °C (54.7 °F; 285.8 K)[1] | ||
| சிதைவடையும் | |||
| கரைதிறன் | CCl4, எத்தனால் இல் கரையும் | ||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.00139 | ||
| கட்டமைப்பு | |||
| மூலக்கூறு வடிவம் | |||
| இருமுனைத் திருப்புமை (Dipole moment) | சுழி | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
-427 கி.யூ/மோல் | ||
| நியம மோலார் எந்திரோப்பி S |
206 யூ/மோல் கெ | ||
| வெப்பக் கொண்மை, C | 107 யூ/மோல் கெ | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | சுவாசிக்க அல்லது விழுங்க நேரிட்டால் உயிர்ச்சேதம் கண்கள், தோல், வாய், நுரையீரல் களில் கடும் எரிச்சல் உண்டாக்கும் | ||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | வார்ப்புரு:ICSC-small | ||
| GHS pictograms |   
| ||
| GHS signal word | அபாயம் | ||
| H330, H300, H314[note 1] | |||
| ஈயூ வகைப்பாடு | |||
| R-சொற்றொடர்கள் | R14, R26/28, R34 | ||
| S-சொற்றொடர்கள் | (S1/2), S9, S26, S28, S36/37/39, S45 | ||
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | போரான் முப்புளோரைடு போரான் முப்புரோமைடு போரான் மூவயோடைடு | ||
| ஏனைய நேர் மின்அயனிகள் | அலுமினியம் குளோரைடு காலியம் குளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
போரான் முக்குளோரைடு (Boron trichloride) BCl3 என்ற வேதியியல் வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் வேதிச் சேர்மம் ஆகும். போரான், மற்றும் குளோரின் சேர்ந்து உருவாகும் இச்சேர்மம் நிறமற்ற வாயுவாகவும், கரிமத் தொகுப்பு வினைகளில் ஒரு பயனுள்ள வினைப்பொருளாகவும் உள்ளது. தண்ணீர்|தண்ணீருடன் அதி தீவிரமாக வினைபுரிகிறது.
தயாரிப்பு
[தொகு]போரான் பொதுவாக ஆலசன்களுடன் வினைபுரிந்து அவற்றுடன் தொடர்புடைய மூவாலைடுகளைத் தருகிறது. தொழிற்சாலைகளில் போரான் முக்குளோரைடானது, 500 பாகை செல்சியசு வெப்பநிலையில் போரான் ஆக்சைடுடன் கார்பன் சேர்த்து நேரடியாக குளோரினேற்றம் செய்யப்பட்டு தயாரிக்கப்படுகிறது.
- B2O3 + 3 C + 3 Cl2 → 2 BCl3 + 3 CO
தைட்டானியம் ஈராக்சைடை, தைட்டானியம் நாற்குளோரைடாக மாற்றக்கூடிய கிரோல் செயல்முறையை இந்த வெப்பக்கரியொடுக்க முறையும் ஒத்துள்ளது. ஆய்வகங்களில் BF3 உடன் AlCl3 சேர்மத்தைச் சேர்த்து ஆலசன் பரிமாற்றத்தின்[2] வழியாக போரான் முக்குளோரைடு தயாரிக்கப்படுகிறது.
கட்டமைப்பு
[தொகு]போரான் முக்குளோரைடு பிற போரான் மூவாலைடுகள் போலவே முக்கோண தள மூலக்கூறு வடிவமைப்பையும், 175 பைக்கோமீட்டர் பிணைப்பு நீளத்தையும் கொண்ட ஒரு சேர்மமாகும். π-பிணைப்ப்பின் பரிமாணம்[2] குறித்து ஒருபுறத்தில் விவாதம் நடந்து கொண்டிருப்பினும், B− Cl பிணைப்பின் குறுகிய நீளத்தைப்பற்றி விளக்க π-பிணைப்பு உருவாதலின் அளவே முன்மொழியப்பட்டது. போரான் மூவாலைடுகளில் கலப்பு ஆலைடுகள் இடம்பெற்ருள்ளன என்று அணுக்கருக் காந்த ஒத்ததிர்வு ஆய்வுகள் தெரிவிக்கின்றன என்றாலும் இது இருபடியாக்கம் அடைவதில்லை. ஆனால் மாறாக, AlCl3 மற்றும் GaCl3 சேர்மங்கள் 4 அல்லது 6 ஒருங்கிணைவு உலோக மையங்களுடன் இருபடியாக்கமும் பலபடியாக்கமும் அடையக்கூடிய தன்மையைக் கொண்டுள்ளன.
வினைகள்
[தொகு]
BCl3 உடனடியாக நீராற்பகுப்பு அடைந்து ஐதரோகுளோரிக் அமிலத்தையும் போரிக் அமிலத்தையும் கொடுக்கிறது.
- :BCl3 + 3 H2O → B(OH)3 + 3 HCl
போரிக் அமிலத்துடன் ஆல்ககால்கள் இதேமுறையில் வினைபுரிந்து மும்மெத்தில் போரேட்டு போன்ற போரேட்டு எசுத்தர்களைக் கொடுக்கிறது.
ஒரு வலிமையான இலூயிசு அமிலமாக BCl3 , மூவிணைய அமீன்கள், பாசுபீன்கள், ஈதர்கள், தயோ ஈதர்கள், ஆலைடு அயனிகளுடன் சேர்ந்து கூட்டு விளைபொருட்களை உருவாக்குகிறது[3]. கூட்டு விளைபொருட்கள் உருவாகும் அதேநேரத்தில் பெரும்பாலும் B-Cl பிணைப்பின் நீள அதிகரிப்பும் நிகழ்கின்றது. BCl3•S(CH3)2 (சிஏசு எண் 5523-19-3) என்ற சேர்மமே பொருத்தமான BCl3 வழங்கும் ஆதார மூலமாகப் பயன்படுத்தப்படுகிறது. ஏனெனில், 88-90 °செ வெப்பநிலையை கொதிநிலையாகக் கொண்ட இத்திண்மமே போரான் முக்குளோரைடை வெளிவிடுகிறது.
- 2 BCl3 + R4Sn → 2 RBCl2 + R2SnCl2
கலப்பு அரைல் மற்றும் ஆல்கைல் போரான் குளோரைடுகளும் அறியப்பட்டுள்ளன. பீனைல்போரான் இருகுளோரைடு வர்த்தகமுறையிலும் விற்பனைக்குக் கிடைக்கிறது. கரிமவெள்ளீயம் வினைபொருட்களுடன் போரான் முக்குளோரைடைச் சேர்த்து மறுபங்கீட்டு வினையின் மூலமாக இத்தகைய கலப்பு போரான் ஆலைடுகள் தயாரிக்கப்படுகின்றன.
2 BCl3 + R4Sn → 2 RBCl2 + R2SnCl2
ஒடுக்கம்
[தொகு]வர்த்தக முறையில் போரான் முக்குளோரைடு தனிமநிலை போரானாக ஒடுக்கப்படுகிறது. ஆய்வகத்தில், போரான் முக்குளோரைடுடன் தாமிரம் உலோகத்தைச் சேர்த்து அதை இருபோரான் நாற்குளோரைடாக ஒடுக்க இயலும் :[4]
- 2 BCl3 + 2 Cu → B2Cl4 + CuCl.
இவ்வழிமுறையிலேயே B4Cl4 சேர்மத்தை தயாரிக்கிறார்கள். நிறமற்ற இந்த இருபோரான் நாற்குளோரைடு (கொதி நிலை -93°செ) திண்மநிலையில் சமதள மூலக்கூற்று அமைப்பிலும் (இருநைட்ரசன் நான்காக்சைடு போல) வாயுநிலையில் மாறுபட்ட எதிரெதிரான அமைப்பிலும் காணப்படுகிறது. அறை வெப்பநிலையில் இது சிதைவடைந்து பல போரான் ஒற்றைக் குளோரைடுகளைக் கொடுக்கிறது. (BCl)n,என்ற பொது வாய்ப்பாட்டுடன் இந்த ஒற்றைக் குளோரைடுகள் உருவாகின்றன. இங்கு n இன் மதிப்பு 8,9,10 அல்லது 11 ஆக இருக்கலாம். B8Cl8 மற்றும் B9Cl9 வாய்ப்பாட்டைக் கொண்டுள்ள சேர்மங்கள் மூடப்பட்டுள்ள கூட்டிற்குள் போரான் அணுக்களைக் கொண்டவையாக உள்ளன.
பயன்கள்
[தொகு]தனிமநிலை போரானைத் தயாரிப்பதற்குரிய தொடக்கநிலை வேதிப்பொருளாக போரான் முக்குளோரைடு பயன்படுகிறது. அலுமினியம், மக்னீசியம், துத்தநாகம், செப்பு உலோகக்கலவைகளில் இருந்து நைட்ரைடு, கார்பைடு போன்ற மாசுக்களை அகற்றி தூய்மையாக்கலிலும் உருகியநிலை உலோகங்களிலிருந்து ஆக்சைடுகளை அகற்றவும் இது பயன்படுகிறது. அலுமினியம், இரும்பு, துத்தநாகம், தங்குதன் மற்றும் மோனெல் எனப்படும் நிக்கல் கலப்புலோகங்களை பற்றவைக்கும் இளக்கியாகவும் பயன்படுகிறது. அலுமினியம் உருகலை போரான் முக்குளோரைடு ஆவியுடன் சேர்த்து சூடுபடுத்துவதன் மூலம் அலுமினிய வார்ப்புகளை மேம்படுத்த இயலும். சீரான மற்றும் நீடித்த பிசின் கார்பன் படலத்தை பீங்கான் மீது BCl3 சேர்மத்தை வைக்க மின் எதிர்ப்புப் பொருட்கள் தயாரிக்க முடியும்.பிரித்தானிய வெப்ப அலகு திறன் மதிப்பை உயர்த்த உதவும் போரான் தனிமத்திற்கு மூலமாக இருப்பதால், உயர் ஆற்றல் எரிபொருள் மற்றும் ஏவூர்தி துறையில் பயன்படுத்தப்பட்டு வருகிறது. மேலும் குறைக்கடத்திகள் உற்பத்தியிலும் இது பயன்படுகிறது. கரிம வேதியியல் தொகுப்பு வினைகளில் போரான் முக்குளோரைடு ஒரு வினைப்பொருளாக உபயோகமாகிறது. தொடர்புடைய போரான் புளோரைடுகள் போல ஈதர்களில் C-O பிணைப்புகளில் பிளவை உண்டாக்குகிறது [1].
முன்பாதுகாப்பு
[தொகு]தீவிரமான வினைப்பொருளாக இருப்பதால் ஆல்ககால்கள் அல்லது ஈரப்பதத்தில் இதனால் ஐதரசன் குளோரைடு வாயுவாக உருவாக முடியும். திண்மமான போரான் இருமெத்தில் சல்பைடு கூட்டுவிளைபொருள் பயன்படுத்துவதற்கு பாதுகாப்பானது என்றாலும்[5], நீருடன் வினைபுரிய வாய்ப்பு ஏற்பட்டால் இச்சேர்மத்தை சிதைத்து கரைசலில் இருமெத்தில் சல்பைடு வாயுவை வெளியிடுகிறது.
மேற்கோள்கள்
[தொகு]- ↑ 1.0 1.1 "Boron Trichloride". Encyclopedia of Reagents for Organic Synthesis. (2004). Ed. Paquette, L.. New York: J. Wiley & Sons. DOI:10.1002/047084289X.rb245.pub2. பன்னாட்டுத் தரப்புத்தக எண் 0471936235.
- ↑ 2.0 2.1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Gerrard, W.; Lappert, M. F. (1958). "Reactions Of Boron Trichloride With Organic Compounds". Chemical Reviews 58 (6): 1081–1111. doi:10.1021/cr50024a003.
- ↑ Wartik, T.; Rosenberg, R.; Fox, W. B. (1967). "Diboron Tetrachloride". Inorganic Syntheses. Vol. 10. pp. 118–125. எண்ணிம ஆவணச் சுட்டி:10.1002/9780470132418.ch18.
- ↑ Williard, Paul G.; Fryhle, Craig B. (1980). "Boron trihalide-methyl sulfide complexes as convenient reagents for dealkylation of aryl ethers". Tetrahedron Letters 21 (39): 3731. doi:10.1016/0040-4039(80)80164-X.
குறிப்பு
[தொகு]- ↑ Within the European Union, the following additional hazard statement (EUH014) must also be displayed on labelling: Reacts violently with water.
மேலும் படிக்க
[தொகு]- Martin, D. R. (1944). "Coordination Compounds of Boron Trichloride. I. - A Review". Chemical Reviews 34 (3): 461–473. doi:10.1021/cr60109a005.
- Kabalka, G. W.; Wu, Z. Z.; Ju, Y. H. (2003). "The Use of Organoboron Chlorides and Bromides in Organic Synthesis". Journal of Organometallic Chemistry 680 (1–2): 12–22. doi:10.1016/S0022-328X(03)00209-2.