Rodoceno
| Rodoceno | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| bis(η5-ciclopentadienil)rodio (II) | ||
| General | ||
| Otros nombres | ciclopentadienil rodio | |
| Fórmula semidesarrollada | [cH-]1cccc1.[cH-]1cccc1.[Rh+2] | |
| Fórmula estructural | cp2Rh | |
| Fórmula molecular | [Rh(C5H5)2] | |
| Identificadores | ||
| Número CAS | 12318-21-7[1] | |
| ChemSpider | 2339512 | |
| PubChem | 3082022 | |
| Propiedades físicas | ||
| Apariencia | sólido amarillo (dímero).[2] | |
| Masa molar | 23 309 g/mol | |
| Punto de fusión | 447,15 K (174 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua |
Insoluble en agua. Poco soluble en diclorometano (dímero).[2] Soluble en acetonitrilo.[2] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El rodoceno, formalmente bis(η5-ciclopentadienil)rodio (II), es un compuesto químico con la fórmula [Rh(C5H5)2]. Cada molécula comprende un átomo de rodio situado entre dos sistemas coplanarios de cinco átomos de carbono, llamados ciclopentadienilos en una disposición tipo «sándwich». Se trata de un compuesto organometálico, específicamente de organorrodio, con enlaces covalentes hápticos entre el rodio y los átomos de carbono.[3] El radical [Rh(C5H5)2] se obtiene por encima de los 150 °C o enfriado con nitrógeno líquido a −196 °C. A temperatura ambiente, los pares de este radical se combinan formando un dímero, un sólido amarillo en el que se unen dos de los ciclopentadienilos.[2][4][5]
La historia de la química organometálica parte de los descubrimientos en el siglo XIX de la sal de Zeise[6][7] y del descubrimiento de Ludwig Mond del tetracarbonilo de níquel.[3] Estos compuestos plantearon un desafío para químicos de la época, pues no encajaban con los modelos de enlace químico descritos hasta entonces. Un reto adicional surgió con el descubrimiento del ferroceno,[8] el análogo con hierro del rodoceno y el primer compuesto conocido de los ahora llamados metalocenos.[9] El ferroceno resultó ser inusualmente estable en términos químicos,[10] como lo son los complejos análogos estructuralmente, como el rodocenio, el catión unipositivo de rodoceno[Nota 1] y sus homólogos de cobalto e iridio.[11] El estudio de especies organometálicas, incluyendo las anteriores, finalmente condujo al desarrollo de nuevos modelos de enlace que explican su formación y su estabilidad.[12][13] Los trabajos de Geoffrey Wilkinson y Ernst Otto Fischer en compuestos tipo «sándwich», incluyendo el sistema rodoceno/rodocenio, fue galardonado con el Premio Nobel de química de 1973.[14]
Debido a su estabilidad y relativa facilidad de preparación, las sales de rodocenio son el material de partida habitual para la preparación de rodoceno y rodoceno sustituido, todos inestables. La síntesis original utiliza un anión ciclopentadienilo y tris(acetilacetonato)rodio(III);[11] Se han publicado otros enfoques, incluida la transmetalación redox en fase gaseosa[15] y el uso de precursores de «medio sándwich» (con un único enlace háptico).[16] El octafenilrodoceno (un derivado con ocho grupos fenilo) fue el primer derivado aislado a temperatura ambiente, aunque aún se descompone rápidamente en el aire. Estudios de cristalografía de rayos X confirmaron que el octafenilrodoceno tiene una estructura tipo «sándwich» con conformación alternada (con los sustituyentes situados alternativamente a uno y otro lado del plano formado por el anillo de ciclopentadienilo).[17] A diferencia del cobaltoceno, que se utiliza como agente reductor de un electrón en los laboratorios de investigación,[18] ningún derivado del rodoceno descubierto hasta ahora tiene suficiente estabilidad para este tipo de aplicaciones.
En investigación médica se han examinado las aplicaciones de compuestos de rodio y sus derivados[19], y se han descrito varias aplicaciones potenciales para un derivado del rodioceno como radiofármaco para tratar pequeños cánceres.[20][21] Los derivados de rodoceno también se utilizan para sintetizar metalocenos enlazados, que permiten estudiar las interacciones metal–metal.[22] Las aplicaciones potenciales de estos derivados incluyen estudios de electrónica molecular y la investigación de los mecanismos de catálisis.[23] El mayor valor de los rodocenos se concentra en los conocimientos que proporcionan sobre el enlace y dinámica de los sistemas químicos, en lugar de su uso directo aplicado.
Historia
[editar]
Los descubrimientos en química organometálica han derivado en importantes descubrimientos sobre el enlace químico. La llamada sal de Zeise, K[PtCl3(C2H4)]·H2O fue sintetizada en 1831[7] y el descubrimiento de Ludwig Mond del Ni(CO)4 ocurrió en 1888.[25] Cada uno contenía un enlace entre un centro de metal y pequeñas moléculas, etileno, en la sal de Zeise y monóxido de carbono en el caso del tetracarbonilo de níquel.[6] El modelo del anión de la sal de Zeise (imagen a la izquierda)[24] muestra el enlace directo entre el centro de metal, platino (en azul) y los átomos de carbono (en negro) del ligando de etileno; dichos enlaces metal–carbono son la característica definitoria de las especies organometálicas. Sin embargo, los modelos de enlace químico de la época no podían explicar la naturaleza de tales enlaces metal-alqueno hasta que se propuso el modelo de Dewar-Chatt-Duncanson en la década de 1950.[12] La formulación original incluía solo los enlaces metal-alqueno,[25] pero el modelo se amplió con el tiempo para cubrir sistemas como los de metal-carbonilos (incluyendo [Ni(CO)4]) donde es fundamental la retrodonación de electrones π.[26]
El ferroceno, [Fe(C5H5)2], fue sintetizado por primera vez en 1951 durante un intento de preparar el biciclopentadienilo (C10H8) por acoplamiento oxidativo del ciclopentadieno; el producto resultante tenía la fórmula molecular C10H10Fe y exhibía una «notable estabilidad».[10] El descubrimiento despertó un renovado interés en el campo de la química organometálica,[8][9] en parte debido a la estructura propuesta por Pauson y Kealy (que se muestra a la derecha) era incompatible con los modelos existentes de enlace y no explicaba su inesperada estabilidad. En consecuencia, el desafío inicial fue determinar definitivamente la estructura del ferroceno con la esperanza de que sus propiedades y enlaces químicos fueran entendidos y se abriera el campo de una nueva familia de metalocenos. La estructura tipo «sándwich» fue deducida y publicada independientemente por tres grupos en 1952: Robert Burns Woodward y Geoffrey Wilkinson investigaron la reactividad a fin de determinar la estructura[27] y demostraron que el ferroceno sufre reacciones similares a una molécula aromática típica (como el benceno),[28] Ernst Otto Fischer no solo dedujo la estructura tipo «sándwich», sino que también comenzó a sintetizar otros metalocenos, incluyendo el cobaltoceno,[29] mientras que Eiland y Pepinsky confirmaron, mediante cristalografía de rayos X, la estructura del complejo.[30] La aplicación de la teoría del enlace de valencia al ferroceno considerando un centro metálico de Fe2+ y dos aniones de ciclopentadienilo (C5H5−), que se sabe que son aromáticos según la regla de Hückel y, por tanto, muy estables, permitió corregir la predicción de la geometría de la molécula. Sin embargo, fue solo después de aplicar la teoría de los orbitales moleculares correctamente cuando quedaron claras las causas de la notable estabilidad del ferroceno.[13]
Las propiedades de los cobaltocenos descritos por Wilkinson y Fischer demostraron que el catión cobaltocinio unipositivo [Co(C5H5)2]+ exhibe una estabilidad similar a la de ferroceno. Este hecho no es inesperado, ya que el catión cobaltocinio y el ferroceno son isoelectrónicos, aunque el tipo de enlace no fue comprendido en el momento. Sin embargo, la investigación llevó a Wilkinson y F. Albert Cotton a conseguir la síntesis de varias sales de rodocenio[Nota 1] e iridoceno.[11] Publicaron la síntesis de numerosas sales de rodocenio, incluyendo algunas con aniones de bromo ([Rh(C5H5)2]Br3), perclorato ([Rh(C5H5)2]ClO4) y reineckatos ([Rh(C5H5)2] [Cr(NCS)4(NH3)2]·H2O) y descubrieron que la adición de dipicrilamina produce un compuesto de composición [Rh(C5H5)2] [N(C6H2N3O6)2].[11] En cada caso, los cationes rodocenio poseen una alta estabilidad. Wilkinson y Fischer compartieron el Premio Nobel de química de 1973 «por sus trabajos pioneros, realizados independientemente, en la química de los organometales, llamados compuestos "sándwich"».[14]
La estabilidad de los metalocenos puede compararse directamente observando los potenciales de la reducción de un electrón del catión unipositivo. A mayor potencial, mayor estabilidad relativa. Los siguientes datos están calculados usando un electrodo de calomelanos saturado (SCE) en acetonitrilo:
- [Fe(C5H5)2]+ / [Fe(C5H5)2] +0,38 V[31]
- [Co(C5H5)2]+ / [Co(C5H5)2] −0,94 V[2]
- [Rh(C5H5)2]+ / [Rh(C5H5)2] −1,41 V[2]
Estos datos indican claramente la estabilidad del ferroceno neutral y de los cationes cobaltocenio y rodocenio. El rodoceno es c. 500 mV más reductor que el cobaltoceno, lo que indica que es más fácilmente oxidado y por lo tanto es menos estable.[2] Una investigación polarográfica anterior del perclorato de rodocenio en pH neutro mostró un pico de onda catódica en −1.53 V (frente a SCE) en el electrodo de gotas de mercurio (DME), correspondiente a la formación de rodoceno en disolución. Sin embargo, los investigadores no pudieron aislar el producto neutro. En el mismo estudio, intentaron detectar iridoceno exponiendo sales de iridocenio en condiciones oxidantes, pero fracasaron incluso a pH elevado.[11] Estos datos son consistentes con la previsión de que el rodoceno es inestable en disolución y puede indicar que el iridoceno es aún más inestable.
Especiación
[editar]
La regla de los 18 electrones es el equivalente de la regla del octeto de la química de grupos principales y ofrece una guía útil para predecir la estabilidad de los compuestos organometálicos.[32] Predice que especies organometálicas «en que la suma de los electrones de valencia del metal más los electrones donados por los grupos ligandos es igual a 18 son probablemente estables».[32] Esta regla ayuda a comprender la estabilidad inusualmente alta observada en el ferroceno[10] y en los cationes cobaltocinio y rodocenio:[29] las tres especies tienen geometrías análogas y son estructuras isoelectrónicas con 18 electrones de valencia. La inestabilidad del rodoceno y cobaltoceno también son comprensibles en términos de la regla de los 18 electrones, pues son estructuras de 19 electrones de valencia. Esto explica las primeras dificultades para el aislamiento del rodoceno en disolución.[11] De hecho, la química del rodoceno está dominada por la búsqueda de una configuración de 18 electrones.
El rodoceno existe como [Rh(C5H5)2], un monómero radical paramagnético con 19 electrones de valencia solo en o por debajo de los −196 °C (temperatura del nitrógeno líquido) o por encima de 150 °C en fase gaseosa.[2][4][5] Es esta forma monomérica la que muestra la estructura escalonada tipo «sándwich» típica. Sin embargo, a temperatura ambiente (25 °C), la vida de la forma monomérica en acetonitrilo es de menos de dos segundos;[2] en su lugar, el rodoceno forma [Rh(C5H5)2]2, un dímero diamagnético con 18 electrones de valencia y estructura de ansa-metaloceno[Nota 2] con un puente.[35]
Técnicas como la resonancia de espín electrónica (ESR), la resonancia magnética nuclear (RMN) y las mediciones de espectroscopia infrarroja (IR) apuntan a la presencia de un equilibrio de interconversión entre las formas de dímero y monómero.[5] Los datos de ESR confirman que el monómero posee un eje de simetría de alto orden Cn, n > 2) con un plano de simetría (σ) perpendicular a él como elemento de simetría. Este hecho demuestra experimentalmente que el monómero poseen la estructura «sándwich» típica de un metaloceno,[4][Nota 3] aunque la interpretación de los datos de ESR ha sido cuestionada.[35] La vía de descomposición del monómero también ha sido estudiada por espectrometría de masas.[36] La dimerización es un proceso reducción-oxidación, en el que el dímero es una especie de rodio (I), mientras que el monómero tiene un centro metálico de rodio (II).[Nota 4] El rodio normalmente posee un estado de oxidación I o III en sus compuestos estables.[37]
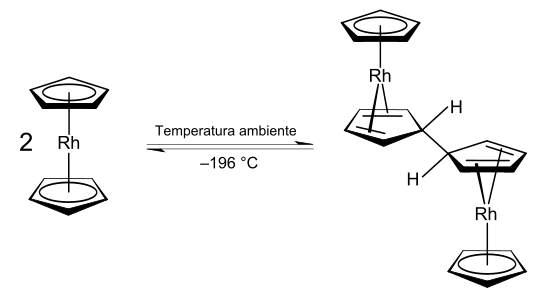
El proceso de dimerización anterior es un equilibrio controlado por la temperatura entre el rodoceno y su dímero. Tiene el efecto de disminuir el número de electrones alrededor del centro de rodio de 19 a 18. Esto ocurre porque el acoplamiento oxidativo de los dos ligandos ciclopentadienilo produce un nuevo ligando con menor hapticidad que dona menos electrones al centro metálico. El término hapticidad se utiliza para indicar el «número de átomos de carbono (u otros) (n) a través del cual se enlaza [un ligando]»[38] a un centro metálico y se simboliza como ηn. Por ejemplo, el ligando etileno en la sal de Zeise está enlazado al centro de platino a través de dos átomos de carbono, y por lo tanto tiene formalmente la fórmula K[PtCl3(η2-C2H4)]·H2O. Los ligandos carbonilo en el tetracarbonilo de níquel están cada uno enlazado a través de un único átomo de carbono y de por eso se describen como ligantes monohapto, pero su nomenclatura η1 normalmente se omite en las fórmulas. Los ligandos ciclopentadienilo en muchos metalocenos y complejos medio sándwich son ligandos pentahaptos, por lo tanto la fórmula es [Rh(η5-C5H5)2] para el monómero del rodoceno. En el dímero, los ligandos acoplados son donantes de 4 electrones tetrahapto a cada centro de metal de rodio (I), en lugar de donantes pentahaptos de 6 electrones.[Nota 5] La mayor estabilidad de las especies del dímero con 18 electrones de valencia y rodio (I) en comparación con el monómero de rodio (II), de 19 electrones de valencia, probablemente explica por qué el monómero es estable solo bajo condiciones extremas.[2][5]

Cotton y Wilkinson demostraron[11] que los cationes de rodocenio del complejo de rodio (III) y 18 electrones de valencia [Rh(η5-C5H5)2]+ pueden ser reducidos en solución acuosa a la forma monomérica. Sin embargo, fueron incapaces de aislar el producto neutro, ya que no solo puede dimerizarse, sino que el monómero radicalario de rodio (II) también puede formar espontáneamente la especie de hapticidad mixta y rodio (I) estable: [(η5-C5H5)Rh(η4-C5H6)].[4] Las diferencias entre el rodoceno y este derivado son fundamentalmente dos:
- Uno de los ligandos ciclopentadienilo enlazado ha ganado un átomo de hidrógeno para convertirse en ciclopentadieno, que sigue siendo dependiente del centro metal, pero ahora como un η4-donante de 4 electrones.
- El centro metálico de rodio (II) se ha reducido a rodio (I).
Estos dos cambios hacen que el derivado sea una especie de 18 electrones. Fischer y sus colegas plantearon la hipótesis de que la formación de este derivado del rodoceno ocurría en dos pasos separados: por un lado la protonación y por otro la reducción, pero no publicaron ninguna evidencia para apoyar esta propuesta.[4] El (η4-ciclopentadieno)(η5-ciclopentadienil)rodio (I), el compuesto resultante, es un complejo organometálico inusual con un anión ciclopentadienilo y otro ciclopentadieno como ligandos. Se ha demostrado que este compuesto también puede ser preparado por reducción con borohidruro de sodio de un rodocenio en disolución etanol:agua; los investigadores que hicieron este descubrimiento caracterizan el producto como hidruro de bisciclopentadienilrodio.[39]
Fischer y sus colaboradores también estudiaron la química del iridoceno, el tercer análogo por serie de transición del rodoceno y cobaltoceno, encontrando que la química del rodoceno y la del iridoceno son similares generalmente. Se han descrito las síntesis de numerosas sales de iridoceno, incluyendo el tribromato y el hexafluorofostato.[5] Como en el caso del rodoceno, el iridoceno dimeriza a temperatura ambiente, pero puede detectarse en forma de monómero a bajas temperaturas y en fase gaseosa. Las mediciones en IR, RMN, y ESR indican que existe un equilibrio químico y confirman la estructura tipo sándwich del monómero de iridoceno.[4][5] El complejo [(η5-C5H5)Ir(η4-C5H6)], el análogo del rodoceno derivado por Fischer,[4] también ha sido estudiado y muestra propiedades compatibles con una mayor retrodonación π en sistemas de iridio (I) que los hallados en los casos análogos de cobalto (I) o rodio (I).[40]
Síntesis
[editar]En primer lugar, se publicaron procesos de síntesis de sales de rodocenio[11] dos años después del descubrimiento del ferroceno.[10] Estas sales se prepararon al reaccionar el carbanión bromuro de ciclopentadienilmagnesio del reactivo de Grignard (C5H5MgBr) con tris(acetilacetonato)rodio (III) (Rh(acac)3). Más recientemente, se han generado cationes rodocenio en fase gaseosa por una reacción de transmetalación redox de iones de rodio (I) con ferroceno o niqueloceno.[15]
- Rh+ + [(η5-C5H5)2M] → M + [(η5-C5H5)2Rh]+ M = Ni o Fe
También se han propuesto modernos métodos sintéticos con microondas.[41] El hexafluorofosfato de rodocenio se forma por la reacción de ciclopentadieno y clorhidrato de rodio (III) en metanol, seguido de exposición a hexafluorofosfato de amonio metanólico. El rendimiento químico de la reacción supera el 60 % con solo 30 segundos de exposición a una radiación de microondas.[42]
- RhCl3.xH2O + 2 C5H6 + NH4PF6 → [(η5-C5H5)2Rh]PF6 + 2 HCl + NH4Cl + xH2O
El rodoceno propiamente, se forma a continuación, por reducción de sales de rodocenio con sodio fundido.[4] Si un fluido derretido que contenga catión rodocenio es tratado con sodio o metales de potasio y sublimado en un dedo frío refrigerado con nitrógeno líquido, el resultado es un material negro policristalino.[35] El calentamiento de este material a la temperatura ambiente produce un sólido amarillo que ha sido confirmado como el dímero del rodoceno. Un método similar puede utilizarse para preparar el dímero del iridoceno.[35]
Rodocenos sustituidos y sales de rodocenio
[editar]El catión [(η5-C5tBu3H2)Rh(η5-C5H5)]+
[editar]Se han desarrollado nuevos enfoques de síntesis de complejos con ciclopentadienilos sustituidos usando vinilciclopropeno sustituido como material de partida.[43][44][45] Son bien conocidas las reacciones de ampliación de anillos por reordenamiento del vinilciclopropeno para producir ciclopentenos[46] y sirven de precedente transformar los vinilciclopropenos en ciclopentadienos. El catión [(η5-C5tBu3H2)Rh(η5-C5H5)]+ se puede generar por una secuencia de reacciones que empiezan con la adición del dímero clorobisetilenrodio (I), [(η2-C2H4)2Rh(μ-Cl)]2, a 1,2,3-tri-tert-butil-3-vinil-1-ciclopropeno, seguido de una reacción con ciclopentadienilo de talio:[43][44]


La especie de 18 electrones de valencia de pentadienil rodio (III) generada por esta reacción demuestra nuevamente la inestabilidad del rodoceno, que puede ser sometido a reflujo en tolueno durante meses sin que forme 1,2,3-tri-tert-butilrodoceno, mientras que en condiciones oxidantes se forman rápidamente los cationes 1,2,3-tri-tert-butilrodocenio.[43] Se han aplicado técnicas de voltamperometría cíclica para investigar este proceso y otros similares en detalle,[43][44] demostrando que el mecanismo de la reacción implica la pérdida de un electrón desde el ligando pentadienilo seguido de una rápida reorganización (con pérdida de un átomo de hidrógeno) para formar el catión 1,2,3-tri-tert-butilrodocenio.[44] Se han caracterizado estructuralmente por cristalografía de rayos X las sales de este catión con tretrafluoroborato y hexafluorofosfato.[44]
[(η5-C5tBu3H2)Rh(η5-C5H5)]BF4 forma un cristal monoclínico incoloro perteneciente al grupo espacial P21/c con una densidad de 1.486 g cm−3.[44] El diagrama de orbitales moleculares de la estructura del catión (a la derecha) indica claramente que posee la geometría típica que se espera de un catión rodocenio o del propio rodoceno. Los dos anillos de ciclopentadienilo están cerca de ser paralelos (el ángulo centroide-átomo de rodio-centroide es de 177.2°) y el centro de rodio está ligeramente más cerca al anillo de ciclopentadienilo sustituido (las distancias centroide-rodio es de 1,819 Å y 1,795 Å), un hecho que se atribuye al mayor efecto inductivo de los grupos tert-butilo en el ligando sustituido.[44] El diagrama también muestra que los cationes adoptan una conformación eclipsada en estado sólido. Sin embargo, la estructura cristalina de la sal de hexafluorofosfato muestra tres cationes cristalográficamente independientes, uno eclipsado, otro alternado y un tercero desordenado rotacionalmente.[44] Esto sugiere que la conformación adoptada es dependiente de los aniones presentes y también muestra que la barrera de energía de la rotación es baja: en el ferroceno, la barrera de energía de rotación es de ~5 kJ mol−1 en solución y fase gaseosa.[13]

El diagrama anterior muestra las longitudes de enlace rodio-carbono (en rojo, dentro de los pentágonos de la izquierda) y carbono–carbono (en azul, fuera de los pentágonos de la izquierda) para ambos ligandos, junto con los ángulos de enlace de ambos (en verde, dentro de pentágonos de la derecha) dentro de cada anillo ciclopentadienilo. Las etiquetas de los átomos utilizadas son las mismos que las que se muestran en la estructura cristalina previamente. En el ligando ciclopentadienilo sustituido, la longitud de enlace carbono–carbono varía entre 1,35 Å y 1,40 Å y los ángulos de enlace internos entre 107° y 109°. En comparación, el ángulo interno en cada vértice de un pentágono regular es de 108°. La longitud de enlace rodio–carbono varía entre 2,16 Å and 2,18 Å.[44] Estos resultados son consistentes con una coordinación η5 del ligando al centro metálico. En el caso de ligando ciclopentadienilo sustituido, existe una variación algo mayor: la longitud de enlace carbono–carbono varía entre 1,39 Å y 1,48 Å, los ángulos de enlace interno entre 106° y 111°, y la longitud de enlace rodio–carbono entre 2,14 Å and 2,20 Å. La mayor variación en el ligando sustituido se atribuye a las distorsiones necesarias para aliviar la tensión estérica impuesta por los sustituyentes tert-butilo vecinos, que, a pesar de su influencia, no impiden que el complejo sea también de coordinación η5.[44]
La estabilidad de los metalocenos cambia con la sustitución del anillo. Comparando los potenciales de reducción de los cationes cobaltocenio y decametilcobaltocenio, se demuestra que la especie sustituida es cerca de 600 mV más reductora que el complejo equivalente no sustituido,[18] una situación que también se observa en el ferroceno[47] y en sistemas derivados del rodoceno.[48] Los siguientes datos se refieren al par redox ferrocenio/ferroceno:[49]
- [Fe(C5H5)2]+ / [Fe(C5H5)2] 0 V (por definición)
- [Fe(C5Me5)2]+ / [Fe(C5Me5)2] −0.59 V[47]
- [Co(C5H5)2]+ / [Co(C5H5)2] −1.33 V[18]
- [Co(C5Me5)2]+ / [Co(C5Me5)2] −1.94 V[18]
- [Rh(C5H5)2]+ / [Rh(C5H5)2] −1.79 V[2] (después de corregir 0,38 V[31] por el uso de diferentes patrones)
- [Rh(C5Me5)2]+ / [Rh(C5Me5)2] −2.38 V[48]
- [(C5tBu3H2)Rh(C5H5)]+ / [(C5tBu3H2)Rh(C5H5)] −1.83 V[44]
- [(C5tBu3H2)Rh(C5Me5)]+ / [(C5tBu3H2)Rh(C5Me5)] −2.03 V[44]
- [(C5H5Ir(C5Me5)]+ / [(C5H5Ir(C5Me5)] −2.41 V[50] (después de corregir 0,38 V[31] por el uso de diferentes patrones)
- [Ir(C5Me5)2]+ / [Ir(C5Me5)2] −2.65 V[50] (después de corregir 0,38 V[31] por el uso de diferentes patrones)
Las diferencias en el potencial de reducción se atribuyen en el sistema de cobaltocenio al efecto inductivo de los grupos alquilo,[18] por la estabilización de las especies de 18 electrones de valencia. Un efecto similar se observa en los datos correspondientes al rodocenio mostrados anteriormente, una vez más coherentes con efectos inductivos.[44] En el sistema de iridocenio sustituido, los estudios con voltamperometría cíclica muestra reducciones irreversibles a temperaturas tan bajas como −60 °C.[50] En comparación, la reducción del rodoceno correspondiente es semirreversible a temperatura ambiente y totalmente reversible a −35 °C.[48] La irreversibilidad de las reducciones de complejos iridocenio sustituidos se atribuye a la dimerización extremadamente rápida de la especie de 19 electrones de valencia 19, que, además, ilustra por qué los iridocenos son menos estables que los rodocenos correspondientes.[50]
Ligandos ciclopentadienilos penta-sustituidos
[editar]Se dispone de un amplio cuerpo de conocimientos sobre compuestos con ligandos ciclopentadienilo penta-sustituidos, siendo los más estudiados los complejos organometálicos de los ligandos pentametilciclopentadieno y pentafenilciclopentadienilo.[51] La sustitución de los anillos de ciclopentadienilo en las sales de rodoceno y rodocenio producen compuestos de mayor estabilidad, ya que permiten la mayor deslocalización de la carga positiva o densidad electrónica, a la vez que proporciona una repulsión estérica sobre otras especies que se acerquen al centro metálico.[36] Se conocen varias especies de rodocenio mono y di sustituido, pero no se obtiene una estabilización sustancial sin usar más sustitutos.[36] Las sales de rodocenio conocidas son el hexafluorofosfato de decametilrodocenio, [(η5-C5Me5)2Rh]PF6,[52] el hexafluorofosfato de decaisopropilrodocenio, [(η5-C5iPr5)2Rh]PF6,[53] y el hexafluorofosfato de octafenilrodocenio, [(η5-C5Ph4H)2Rh]PF6.[17][Nota 6] El hexafluorofosfato de decametilrodocenio puede ser sintetizado desde el complejo de tris(acetona) [(η5-C5Me5)Rh(Me2CO)3](BF4)2 por reacción con pentametilciclopentadieno; también se conoce la síntesis del análogo de iridio.[54] El hexafluorofosfato de decaisopropilrodocenio fue sintetizado en 1,2-dimetoxietano como disolvente en una inusual síntesis one-pot que implica la formación de 20 enlaces carbono-carbono:[53]
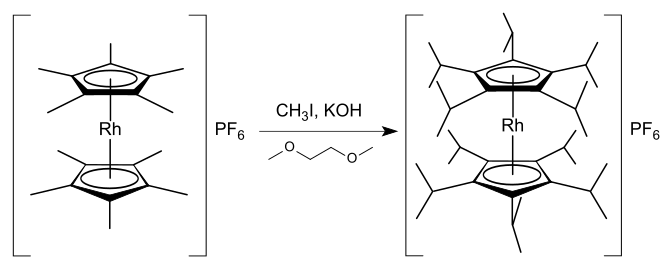
En una reacción similar, se puede sintetizar hexafluoruro de pentaisopropilrodocenio [(η5-C5iPr5)Rh(η5-C5H5)]PF6 a partir de hexafluoruro de pentametilrodocenio [(η5-C5Me5)Rh(η5-C5H5)]PF6 con un 80 % de rendimiento.[53] Estas reacciones demuestran que la acidez de los átomos de hidrógeno en los grupos metilo de un complejo de pentametilciclopentadienilo puede ser aumentada considerablemente por la presencia del centro metálico. Mecanísticamente, la reacción se produce mediante la desprotonación de un grupo metil con hidróxido de potasio y la sustitución nucleófila del carbanión resultante con yoduro de metilo para formar un nuevo enlace carbono-carbono.[53]
Se conocen también procesos de síntesis para compuestos como el tetrafluoroborato de pentafenilrodocenio [(η5-C5Ph5)Rh(η5-C5H5)]BF4 y el tetrafluoroborato de pentametilpentafenilrodocenio [(η5-C5Ph5)Rh(η5-C5Me5)]BF4, que demuestran que los compuestos tipo «sándwich» de rodio pueden prepararse a partir de precursores de tipo «medio sándwich» (con un solo ligando perpendicular. Por ejemplo, en un enfoque similar a la síntesis con tris(acetona) del tetrafluoroborato de decametilrodocenio,[54] ha sido sintetizado tetrafluoroborato de pentafenilrodocenio a partir de la sal de tris(acetonitrilo) [(η5-C5Ph5)Rh(CH3CN)3](BF4)2 por reacción con ciclopentadienuro de sodio:[16]
- [(η5-C5Ph5)Rh(MeCN)3](BF4)2 + NaC5H5 → [(η5-C5Ph5)Rh(η5-C5H5)]BF4 + NaBF4 + 3 MeCN

El octofenil rodoceno, [(η5-C5Ph4H)2Rh], es el primer derivado del rodoceno aislado a temperatura ambiente. Sus cristales de color verde oliva se descomponen rápidamente en disolución y en pocos minutos en el aire, demostrando una sensibilidad al aire considerablemente mayor que los complejos análogos de cobalto, aunque es mucho más estable que el rodoceno en sí. Esta diferencia se atribuye a la relativamente baja estabilidad del estado de oxidación rodio(II), en comparación con el cobalto(II).[17][37] El potencial de reducción potencial del catión [(η5-C5Ph4H)2Rh]+ (medido en dimetilformamida y relativa al par ferrocenio/ferroceno) es −1.44 V, dato consistente con la mayor estabilización termodinámica del rodoceno por el ligando C5HPh4 en comparación con el C5H5 o el C5Me5.[17] El cobaltoceno es un agente reductor de un electrón en investigación, ya que es soluble en disolventes orgánicos no polares,[18] y su par redox es lo suficientemente estable para ser utilizado como patrón interno en voltametría cíclica.[55] Ninguno de los rodocenos sustituidos que se han preparado hasta el momento han demostrado una estabilidad suficiente para ser utilizado de forma similar.
La síntesis de octafenil rodoceno se desarrolla en tres pasos, con un reflujo diglima (éter bis(2-metoxietílico)) seguido de una reacción con ácido hexafluorofosfórico y una reducción con amalgama de sodio en tetrahidrofurano:[17]
- Rh(acac)3 + 2 KC5Ph4H → [(η5-C5Ph4H)2Rh]+ + 2 K+ + 3 acac−
- [(η5-C5Ph4H)2Rh]+ + 3 acac− + 3 HPF6 → [(η5-C5Ph4H)2Rh]PF6 + 3 Hacac + 2 PF6−
- [(η5-C5Ph4H)2Rh]PF6 + Na/Hg → [(η5-C5Ph4H)2Rh] + NaPF6
La estructura cristalina del octafenil rodoceno muestra una conformación alternada[17] (similar a la del ferroceno y diferente a la conformación eclipsada del rutenoceno).[13] La distancia rodio–centroide es 1,904 Å y la longitud promedio del enlace rodio–carbono de 2,26 Å, mientras que la longitud promedio del enlace carbono–carbono es de 1.44 Å.[17] Estas distancias son similares a las encontradas en el catión 1,2,3-tri-terc-butilrodocenio descrito anteriormente, con la única diferencia que el tamaño efectivo del centro de rodio aparece más grande, una observación coherente con el radio iónico mayor del rodio(II) en comparación con el rodio(III).
Aplicaciones
[editar]Uso biomédico de sus derivados
[editar]
Ha habido una amplia investigación en metalomedicamentos,[56][57] incluyendo el uso de compuestos de rodio en medicina.[19] Un cuerpo considerable de investigación ha examinado el uso de derivados metalocénicos de rutenio[58] y hierro[59] como medicamentos. Un área de esa investigación ha utilizado metalocenos en lugar del grupo fluorofenilo del haloperidol,[20] que es un medicamento convencional clasificado como un antipsicótico típico.
El compuesto ferrocenil-haloperidol investigado, de fórmula química (C5H5)Fe(C5H4)–C(=O)–(CH2)3–N(CH2CH2)2C(OH)–C6H4Cl puede ser transforamdo en su análogo de rutenio a través de una relación de transmetalación. Usando isótopos radiactivos 103Ru se produce un radiofármaco, rutenocenil–haloperidol, con una gran afinidad por tejidos pulmonares, pero no cerebrales en ratones y ratas.[20]
La desintegración beta del 103Ru produce el isótopo metaestable 103mRh en un compuesto rodocenil-haloperidol que, como otros derivados del rodoceno, tiene una configuración de 19 electrones de valencia, por lo que es inestable y rápidamente se oxida a la especie catiónica rodocenio–haloperidol.[20]
Se ha estudiado la separación del rutenocenil-haloperidol y del rodocenio-haloperidol y la distribución de ambos entre los órganos corporales.[21] El 103mRh tiene una vida media de 56 min y emite un rayo gamma de energía 39,8 keV, por lo que el isótopo de rodio debe seguir una desintegración gamma poco después de la desintegración beta del isótopo de rutenio. Algunos radioisótopos emisores beta y gamma utilizados médicamente son el 131I, el 59Fe y el 47Ca. Se ha propuesto que el 103mRh pueda ser usado en radioterapia para tumores pequeños.[19]
Interacciones metal-metal en rodocenos enlazados
[editar]
La motivación original para el estudio del sistema del rodoceno fue comprender la naturaleza y el enlace dentro de los metalocenos. En tiempos más recientes, se ha reavivado interés por el deseo de estudiar y aplicar útilmente las interacciones metal–metal que se producen en estos sistemas.[22] Posibles aplicaciones para tales sistemas son los estudios sobre electrónica molecular,[23] semiconductores (y, posiblemente, compuestos ferromagnéticos) polímeros de metaloceno (para formar cables moleculares),[22] y explorar el umbral entre catalizadores homogéneos y heterogéneos.[23] Por ejemplo, se están estudiando sales de hexafluorofosfatos de rodocenilferroceno, 1,1'-dirodocenilferroceno y 1-cobaltocenil-1'-rodocenilferroceno, ejemplos de bi- y ter-metalocenos,[60] representados a la derecha. También se pueden formar metalocenos enlazados mediante la introducción de varios sustituyentes metalocenilos en un único ligando ciclopentadienilo.[23]
Los estudios estructurales de los sistemas de termetalocenos han mostrado que normalmente adoptan una geometría de «eclipsada de doble transoide», conocida popularmente como «de cigüeñal».[61] Tomando como ejemplo el catión 1-cobaltocenil-1'-rodocenilferroceno, representado anteriormente, este hecho implica que los cobaltocenilos y rodocenilos se colocan de forma eclipsada y así los átomos de carbono 1 y 1' en el núcleo central del ferroceno se alinean verticalmente todo lo posible dada la conformación alternada de los anillos de ciclopentadienilo dentro de cada unidad de metaloceno. Visto desde este punto, los termetalocenos se asemejan a los patrones abajo-arriba-abajo de una cigüeña.[61] La síntesis de este termetaloceno implica la combinación de soluciones de rodocenio y cobaltocenio con 1, 1'-dilitioferroceno. Esta reacción produce un intermediario neutro con ligandos ciclopentadienil–ciclopentadieno unidos cuyo enlace se asemeja a la encontrada en el dímero del rodoceno. Estos ligandos reaccionan a continuación con el carbocatión de trifenilfosfato para general la sal del metaloceno, [(η5-C5H5)Rh(μ-η5:η5-C5H4–C5H4)Fe(μ-η5:η5-C5H4–C5H4)Co(η5-C5H5)](PF6)2, según la siguiente reacción:[60][61]

Notas
[editar]- ↑ a b El catión de 18 electrones de valencia [Rh(C5H5)2]+ es llamado rodocenio («rhodocenium») en algunos artículos científicos[2] y catión rodocénico en otros.[11] La primera nomenclatura parece más común en la literatura reciente y por eso es la adoptada en este artículo, pero ambas formulaciones se refieren a la misma especie química.
- ↑ Es decir, con un puente entre dos sustituyentes de los ligandos.[33][34]
- ↑ La presencia del plano de simetría perpendicular al eje de simetría trazado entre el centroide del anillo C5–metal–centroide sugiere una conformación eclipsada frente a una alternada. Sin embargo, la rotación libre de los ligandos ciclopentadienilos alrededor de este eje es común en los metalocenos. En el ferroceno, por ejemplo, la barrera energética de la rotación es de ~5 kJ mol−1,[13] por lo que pueden coexistir ambas conformaciones en el monómero de rodoceno, interconvirtiéndose rápidamente en disolución. Sólo la conformación final en estado sólido proporciona información significativa sobre la posición real de los ligandos.
- ↑ En el dímero de rodoceno, los anillos de ciclopentadienilo unidos se muestran en la posición endo (es decir, con los hidrógenos hacia dentro y la otra mitad de los ligandos hacia fuera. Aunque esta estructura no está basada en los datos cristalográficos, sigue las ilustraciones proporcionadas por El Murr et al.[2] y por Fischer y Wawersik[4] en su discusión sobre los datos de resonancia magnética nuclear de 1H que publicaron. El artículo de Collins et al.,[17] sin embargo, muestra los átomos de hidrógeno en isomería exo.
- ↑ Hay dos aproximaciones diferentes para el conteo de electrones, basado bien en especies radicalarias o en especies iónicas. Desde la aproximación radicalaria, el centro de rodio tiene 9 electrones independientemente de su estado de oxidación y el ligando ciclopentadienilo es un donante de 5 electrones. En la aproximación iónica, el ligando ciclopentadienilo es un donante de 6 electrones y el conteo de electrones del centro de rodio depende de su estado de oxidación (el rodio (I) es un centro de 8 electrones, el rodio (II) de 7 y el rodio (III) de 6). Las dos aproximaciones generalmente llegan a las mismas conclusiones, pero es importante ser consistentes al usar una u otra.
- ↑ Existen abreviaturas comunes para fragmentos moleculares en especies químicas: "Me" se refiere al grupo metilo, —CH3; "iPr" es el grupo isopropilo, —CH(CH3)2; "Ph" se refiere al grupo fenilo—C6H5; "tBu" es el grupo tert-butilo, —C(CH3)3.
Referencias
[editar]- ↑ Número CAS
- ↑ a b c d e f g h i j k l m El Murr, N.; Sheats, J. E.; Geiger, W. E.; Holloway, J. D. L. (1979). «Electrochemical Reduction Pathways of the Rhodocenium Ion. Dimerization and Reduction of Rhodocene». Inorg. Chem. 18 (6): 1443-1446. doi:10.1021/ic50196a007.
- ↑ a b Crabtree, R. H. (2009). The Organometallic Chemistry of the Transition Metals (5ª edición). Hoboken, NJ: John Wiley and Sons. p. 2. ISBN 978-0-470-25762-3. «An industrial application of transition metal organometallic chemistry appeared as early as the 1880s, when Ludwig Mond showed that nickel can be purified by using CO to pick up nickel in the form of gaseous Ni(CO)4 that can easily be separated from solid impurities and later be thermally decomposed to give pure nickel.
... Recent work has shown the existence of a growing class of metalloenzymes having organometallic ligand environments – considered as the chemistry of metal ions having C-donor ligands such as CO or the methyl group».
- ↑ a b c d e f g h i j Fischer, E. O.; Wawersik, H. (1966). «Über Aromatenkomplexe von Metallen. LXXXVIII. Über Monomeres und Dimeres Dicyclopentadienylrhodium und Dicyclopentadienyliridium und Über Ein Neues Verfahren Zur Darstellung Ungeladener Metall-Aromaten-Komplexe». J. Organomet. Chem. (en alemán) 5 (6): 559-567. doi:10.1016/S0022-328X(00)85160-8.
- ↑ a b c d e f Keller, H. J.; Wawersik, H. (1967). «Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir». J. Organomet. Chem. (en alemán) 8 (1): 185-188. doi:10.1016/S0022-328X(00)84718-X.
- ↑ a b Hunt, L. B. (1984). «The First Organometallic Compounds: William Christopher Zeise and his Platinum Complexes». Platinum Metals Rev. 28 (2): 76-83. Archivado desde el original el 24 de septiembre de 2015. Consultado el 8 de noviembre de 2011.
- ↑ a b Zeise, W. C. (1831). «Von der Wirkung zwischen Platinchlorid und Alkohol, und von den dabei entstehenden neuen Substanzen». Ann. der Physik (en alemán) 97 (4): 497-541. doi:10.1002/andp.18310970402.
- ↑ a b Laszlo, P.; Hoffmann, R. (2000). «Ferrocene: Ironclad History or Rashomon Tale?». Angew. Chem. Int. Ed. 39 (1): 123-124. PMID 10649350. doi:10.1002/(SICI)1521-3773(20000103)39:1<123::AID-ANIE123>3.0.CO;2-Z.
- ↑ a b Federman Neto, A.; Pelegrino, A. C.; Darin, V. A. (2004). «Ferrocene: 50 Years of Transition Metal Organometallic Chemistry — From Organic and Inorganic to Supramolecular Chemistry». ChemInform 35 (43). doi:10.1002/chin.200443242. (Abstract, originalmente publicado en Trends Organomet. Chem., 4:147–169, 2002)
- ↑ a b c d Kealy, T. J.; Pauson, P. L. (1951). «A New Type of Organo-Iron Compound». Nature 168 (4285): 1039-1040. doi:10.1038/1681039b0.
- ↑ a b c d e f g h i Cotton, F. A.; Whipple, R. O.; Wilkinson, G. (1953). «Bis-Cyclopentadienyl Compounds of Rhodium(III) and Iridium(III)». J. Am. Chem. Soc. 75 (14): 3586-3587. doi:10.1021/ja01110a504.
- ↑ a b Mingos, D. M. P. (2001). «A Historical Perspective on Dewar's Landmark Contribution to Organometallic Chemistry». J. Organomet. Chem. 635 (1–2): 1-8. doi:10.1016/S0022-328X(01)01155-X.
- ↑ a b c d e f Mehrotra, R. C.; Singh, A. (2007). Organometallic Chemistry: A Unified Approach (2ª edición). New Delhi: New Age International. pp. 261-267. ISBN 978-81-224-1258-1.
- ↑ a b «The Nobel Prize in Chemistry 1973». Nobel Foundation. Consultado el 12 de septiembre de 2010.
- ↑ a b Jacobson, D. B.; Byrd, G. D.; Freiser, B. S. (1982). «Generation of Titanocene and Rhodocene Cations in the Gas Phase by a Novel Metal-Switching Reaction». J. Am. Chem. Soc. 104 (8): 2320-2321. doi:10.1021/ja00372a041.
- ↑ a b He, H. T. (1999). Synthesis and Characterisation of Metallocenes Containing Bulky Cyclopentadienyl Ligands (PhD thesis). University of Sydney. OCLC 222646266.
- ↑ a b c d e f g h Collins, J. E.; Castellani, M. P.; Rheingold, A. L.; Miller, E. J.; Geiger, W. E.; Rieger, A. L.; Rieger, P. H. (1995). «Synthesis, Characterization, and Molecular-Structure of Bis(tetraphenylcyclopentadienyl)rhodium(II)». Organometallics 14 (3): 1232-1238. doi:10.1021/om00003a025.
- ↑ a b c d e f Connelly, N. G.; Geiger, W. E. (1996). «Chemical Redox Agents for Organometallic Chemistry». Chem. Rev. 96 (2): 877-910. PMID 11848774. doi:10.1021/cr940053x.
- ↑ a b c Pruchnik, F. P. (2005). «45Rh — Rhodium in Medicine». En Gielen, M.; Tiekink, E. R. T, eds. Metallotherapeutic Drugs and Metal-Based Diagnostic Agents: The Use of Metals in Medicine. Hoboken, NJ: Wiley. pp. 379-398. ISBN 0-470-86403-6. doi:10.1002/0470864052.ch20.
- ↑ a b c d Wenzel, M.; Wu, Y. (1988). «Ferrocen-, Ruthenocen-bzw. Rhodocen-analoga von Haloperidol Synthese und Organverteilung nach Markierung mit 103Ru-bzw. 103mRh». Int. J. Rad. Appl. Instrum. A. (en alemán) 39 (12): 1237-1241. PMID 2851003. doi:10.1016/0883-2889(88)90106-2.
- ↑ a b Wenzel, M.; Wu, Y. F. (1987). «Abtrennung von [103mRh]Rhodocen-Derivaten von den Analogen [103Ru]Ruthenocen-Derivaten und deren Organ-Verteilung». Int. J. Rad. Appl. Instrum. A. (en alemán) 38 (1): 67-69. PMID 3030970. doi:10.1016/0883-2889(87)90240-1.
- ↑ a b c Barlow, S.; O'Hare, D. (1997). «Metal–Metal Interactions in Linked Metallocenes». Chem. Rev. 97 (3): 637-670. doi:10.1021/cr960083v.
- ↑ a b c d Wagner, M. (2006). «A New Dimension in Multinuclear Metallocene Complexes». Angew. Chem. Int. Ed. 45 (36): 5916-5918. doi:10.1002/anie.200601787.
- ↑ a b Jarvis, J. A. J.; Kilbourn, B. T.; Owston, P. G. (1971). «A Re-determination of the Crystal and Molecular Structure of Zeise's salt, KPtCl3.C2H4.H2O». Acta Cryst. B 27 (2): 366-372. doi:10.1107/S0567740871002231.
- ↑ a b Leigh, G. J.; Winterton, N., eds. (2002). «Section D: Transition Metal Complexes of Olefins, Acetylenes, Arenes and Related Isolobal COmpounds». Modern Coordination Chemistry: The Legacy of Joseph Chatt. Cambridge, UK: RSC Publishing. pp. 101-110. ISBN 978-0-85404-469-6.
- ↑ Astruc, D. (2007). Organometallic Chemistry and Catalysis. Berlín: Springer. pp. 41-43. ISBN 978-3-540-46128-9.
- ↑ Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. (1952). «The Structure of Iron Bis-Cyclopentadienyl». J. Am. Chem. Soc. 74 (8): 2125-2126. doi:10.1021/ja01128a527.
- ↑ Werner, H. (2008). Landmarks in Organo-Transition Metal Chemistry: A Personal View. New York: Springer Science. pp. 161-163. ISBN 978-0-387-09847-0.
- ↑ a b Fischer, E. O.; Pfab, W. (1952). «Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels». Z. Anorg. Allg. Chem. (en alemán) 7 (6): 377-379. doi:10.1002/zaac.19532740603.
- ↑ Eiland, P. F.; Pepinsky, R. (1952). «X-ray Examination of Iron Biscyclopentadienyl». J. Am. Chem. Soc. 74 (19): 4971. doi:10.1021/ja01139a527.
- ↑ a b c d Pavlishchuk, V. V.; Addison, A. W. (2000). «Conversion Constants for Redox Potentials Measured Versus Different Reference Electrodes in Acetonitrile Solutions at 25 °C». Inorg. Chim. Acta 298 (1): 97-102. doi:10.1016/S0020-1693(99)00407-7.
- ↑ a b Kotz, J. C.; Treichel, P. M.; Townsend, J. R. (2009). Chemistry and Chemical Reactivity, Volume 2 (7ª edición). Belmont, CA: Cengage Learning. pp. 1050-1053. ISBN 978-0-495-38703-9.
- ↑ Bajgur, Chandrasekhar S.; Tikkanen, Wayne; Petersen, Jeffrey L. (1985). «Synthesis, structural characterization, and electrochemistry of [1]metallocenophane complexes, [Si(alkyl)2(C5H4)2]MCl2, M = Ti, Zr». Inorganic Chemistry 24 (16): 2539. doi:10.1021/ic00210a015.
- ↑ Lüttringhaus, A.; Kullick, W. (1958). «Ansa-Ferrocene». Angewandte Chemie 70 (14): 438. ISBN 9580701407. doi:10.1002/ange.19580701407.
- ↑ a b c d De Bruin, B.; Hetterscheid, D. G. H.; Koekkoek, A. J. J.; Grützmacher, H. (2007). «The Organometallic Chemistry of Rh–, Ir–, Pd–, and Pt–Based Radicals: Higher Valent Species». Prog. Inorg. Chem. 55: 247-354. ISBN 978-0-471-68242-4. doi:10.1002/9780470144428.ch5.
- ↑ a b c Zagorevskii, D. V.; Holmes, J. L. (1992). «Observation of Rhodocenium and Substituted-Rhodocenium Ions and their Neutral Counterparts by Mass Spectrometry». Organometallics 11 (10): 3224-3227. doi:10.1021/om00046a018.
- ↑ a b S. A., Cotton (1997). «Rhodium and Iridium». Chemistry of Precious Metals. London: Blackie Academic and Professional. pp. 78-172. ISBN 978-0-7514-0413-5. «Both metals exhibit an extensive chemistry, principally in the +3 oxidation state, with +1 also being important, and a significant chemistry of +4 iridium existing. Few compounds are known in the +2 state, in contrast to the situation for cobalt, their lighter homologue (factors responsible include the increased stability of the +3 state consequent upon the greater stabilization of the low spin d6 as 10 Dq increases)." (p. 78)».
- ↑ Hill, A. F. (2002). Organotransition Metal Chemistry. Cambridge, UK: Royal Society of Chemistry. pp. 4-7. ISBN 978-0-85404-622-5.
- ↑ Green, M. L. H.; Pratt, L.; Wilkinson, G. (1959). «760. A New Type of Transition Metal–Cyclopentadiene Compound». J. Chem. Soc.: 3753-3767. doi:10.1039/JR9590003753.
- ↑ Szajek, L. P.; Shapley, J. R. (1991). «Unexpected Synthesis of CpIr(η4-C5H6) and a Proton and Carbon-13 NMR Comparison with its Cobalt and Rhodium Congeners». Organometallics 10 (7): 2512-2515. doi:10.1021/om00053a066.
- ↑ Baghurst, D. R.; Mingos, D. M. P. (1990). «Design and Application of a Reflux Modification for the Synthesis of Organometallic Compounds Using Microwave Dielectric Loss Heating Effects». J. Organomet. Chem. 384 (3): C57-C60. doi:10.1016/0022-328X(90)87135-Z.
- ↑ Baghurst, D. R.; Mingos, D. M. P.; Watson, M. J. (1989). «Application of Microwave Dielectric Loss Heating Effects for the Rapid and Convenient Synthesis of Organometallic Compounds». J. Organomet. Chem. 368 (3): C43-C45. doi:10.1016/0022-328X(89)85418-X.
- ↑ a b c d Donovan-Merkert, B. T.; Tjiong, H. I.; Rhinehart, L. M.; Russell, R. A.; Malik, J. (1997). «Facile, Redox-Promoted Formation of Rhodocenium Complexes Bearing the 1,2,3-Tri-tert-butylcyclopentadienyl Ligan». Organometallics 16 (5): 819-821. doi:10.1021/om9608871.
- ↑ a b c d e f g h i j k l m n ñ Donovan-Merkert, B. T.; Clontz, C. R.; Rhinehart, L. M.; Tjiong, H. I.; Carlin, C. M.; Cundari, Thomas R.; Rheingold, Arnold L.; Guzei, Ilia (1998). «Rhodocenium Complexes Bearing the 1,2,3-Tri-tert-butylcyclopentadienyl Ligand: Redox-Promoted Synthesis and Mechanistic, Structural and Computational Investigations». Organometallics 17 (9): 1716-1724. doi:10.1021/om9707735.
- ↑ Hughes, R. P.; Trujillo, H. A.; Egan, J. W.; Rheingold, A. L. (1999). «Skeletal Rearrangement during Rhodium-Promoted Ring Opening of 1,2-Diphenyl-3-vinyl-1-cyclopropene. Preparation and Characterization of 1,2- and 2,3-Diphenyl-3,4-pentadienediyl Rhodium Complexes and Their Ring Closure to a 1,2-Diphenylcyclopentadienyl Complex». Organometallics 18 (15): 2766-2772. doi:10.1021/om990159o.
- ↑ Goldschmidt, Z.; Crammer, B. (1988). «Vinylcyclopropane Rearrangements». Chem. Soc. Rev. 17: 229-267. doi:10.1039/CS9881700229.
- ↑ a b Noviandri, I.; Brown, K. N.; Fleming, D. S.; Gulyas, P. T.; Lay, P. A.; Masters, A. F.; Phillips, L. (1999). «The Decamethylferrocenium/Decamethylferrocene Redox Couple: A Superior Redox Standard to the Ferrocenium/Ferrocene Redox Couple for Studying Solvent Effects on the Thermodynamics of Electron Transfer». J. Phys. Chem. B 103 (32): 6713-6722. doi:10.1021/jp991381.
- ↑ a b c Gusev, O. V.; Denisovich, L. I.; Peterleitner, M. G.; Rubezhov, A. Z.; Ustynyuk, Nikolai A.; Maitlis, P. M. (1993). «Electrochemical Generation of 19- and 20-electron Rhodocenium Complexes and Their Properties». J. Organomet. Chem. 452 (1–2): 219-222. doi:10.1016/0022-328X(93)83193-Y.
- ↑ Gagne, R. R.; Koval, C. A.; Lisensky, G. C. (1980). «Ferrocene as an Internal Standard for Electrochemical Measurements». Inorg. Chem. 19 (9): 2854-2855. doi:10.1021/ic50211a080.
- ↑ a b c d Gusev, O. V.; Peterleitner, M. G.; Ievlev, M. A.; Kal'sin, A. M.; Petrovskii, P. V.; Denisovich, L. I.; Ustynyuk, Nikolai A. (1997). «Reduction of Iridocenium Salts [Ir(η5-C5Me5)(η5-L)]+ (L= C5H5, C5Me5, C9H7); Ligand-to-Ligand Dimerisation Induced by Electron Transfer». J. Organomet. Chem. 531 (1–2): 95-100. doi:10.1016/S0022-328X(96)06675-2.
- ↑ Okuda, J. (1992). «Transition-Metal Complexes of Sterically Demanding Cyclopentadienyl Ligands». En W. A., Herrmann, ed. Transition Metal Coordination Chemistry. Topics in Current Chemistry 160. Berlín: Springer-Verlag. pp. 97-145. ISBN 3-540-54324-4. doi:10.1007/3-540-54324-4_3.
- ↑ Kölle, U.; Kläui, W. Z.l (1991). «Darstellung und Redoxverhalten einer Serie von Cp*/aqua/tripod-Komplexen des Co, Rh und Ru». Z. Naturforsch. B. (en alemán) 46 (1): 75-83.
- ↑ a b c d Buchholz, D.; Astruc, D. (1994). «The First Decaisopropylmetallocene – One-Pot Synthesis of [Rh(C5iPr5)2]PF6 from [Rh(C5Me5)2]PF6 by Formation of 20 Carbon–Carbon Bonds». Angew. Chem. Int. Ed. 33 (15–16): 1637-1639. doi:10.1002/anie.199416371.
- ↑ a b Gusev, O. V.; Morozovaa, L. N.; Peganovaa, T. A.; Petrovskiia, P. V.; Ustynyuka N. A.; Maitlis, P. M. (1994). «Synthesis of η5-1,2,3,4,5-Pentamethylcyclopentadienyl-Platinum Complexes». J. Organomet. Chem. 472 (1–2): 359-363. doi:10.1016/0022-328X(94)80223-8.
- ↑ Stojanovic, R. S.; Bond, A. M. (1993). «Examination of Conditions under which the Reduction of the Cobaltocenium Cation can be used as a Standard Voltammetric Reference Process in Organic and Aqueous Solvents». Anal. Chem. 65 (1): 56-64. doi:10.1021/ac00049a012.
- ↑ Clarke, M. J.; Sadler, P. J. (1999). Metallopharmaceuticals: Diagnosis and therapy. Berlín: Springer. ISBN 978-3-540-65308-0.
- ↑ Jones, C. J.; Thornback, J. (2007). Medicinal Applications of Coordination Chemistry. Cambridge, UK: RSC Publishing. ISBN 978-0-85404-596-9.
- ↑ Clarke, M. J. (2002). «Ruthenium Metallopharmaceuticals». Coord. Chem. Rev. 232 (1–2): 69-93. doi:10.1016/S0010-8545(02)00025-5.
- ↑ Fouda, M. F. R.; Abd-Elzaher, M. M.; Abdelsamaia, R. A.; Labib, A. A. (2007). «On the Medicinal Chemistry of Ferrocene». Appl. Organomet. Chem. 21 (8): 613-625. doi:10.1002/aoc.1202.
- ↑ a b c Andre, M.; Schottenberger, H.; Tessadri, R.; Ingram, G.; Jaitner, P.; Schwarzhans, K. E. (1990). «Synthesis and Preparative HPLC-Separation of Heteronuclear Oligometallocenes. Isolation of Cations of Rhodocenylferrocene, 1,1'-Dirhodocenylferrocene, and 1-Cobaltocenyl-1'-rhodocenylferrocene». Chromatographia 30 (9–10): 543-545. doi:10.1007/BF02269802.
- ↑ a b c Jaitner, P.; Schottenberger, H.; Gamper, S.; Obendorf, D. (1994). «Termetallocenes». J. Organomet. Chem. 475 (1–2): 113-120. doi:10.1016/0022-328X(94)84013-X.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Rodoceno.
Wikimedia Commons alberga una categoría multimedia sobre Rodoceno.
- Esta obra contiene una traducción total derivada de «Rhodocene» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.


